Visualiser comment un anticorps de chameaux neutralise un virus de la vigne
12/06/2020
Des chercheurs de l’Institut de biologie moléculaire des plantes (IBMP), de l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC) et de l’Institut national de recherche pour l’agriculture, l’alimentation et l’environnement (INRAE) sont parvenus pour la première fois à observer la structure à l’échelle atomique du complexe formé par le virus responsable de la maladie du court-noué de la vigne et d’un anticorps capable de le neutraliser : le Nanobody 23.
Quasiment incurable, la maladie du court-noué de la vigne affecte les vignobles de nombreuses régions viticoles du monde. Pour tenter de neutraliser le virus responsable de cette maladie, depuis 2011, le laboratoire de Christophe Ritzenthaler, chercheur à l’IBMP, a initié une collaboration avec Serge Muyldermans, un des pères fondateurs des Nanobodies, des fragments d'anticorps de camélidés facilement manipulables (cf encadré). « Nous en avons testé plusieurs dizaines qui réagissent tous avec le virus dont le Nanobody 23. »
Résultat : Lorsque le Nanobody 23 (Nb 23) est exprimé dans une plante, elle devient résistante au virus. La découverte, publiée en 2018, intéresse le milieu des biotechnologies. Grâce à elle, en février 2020, le chercheur obtient un Labcom (Laboratoires communs organismes de recherche publics) avec un partenaire privé pour créer une vigne résistante au virus.
La structure à l’échelle atomique
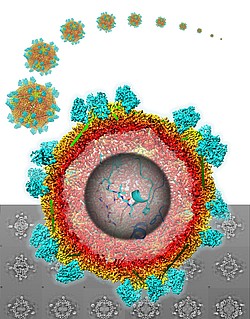
Afin de comprendre le mécanisme sous-jacent, Christophe Ritzenthaler s’associe à Bruno Klaholz, spécialiste en cryo-microscopie électronique (cryo-EM) à l’IGBMC. « En étudiant le virus purifié en interaction avec Nb 23 par cryo-EM, nous avons pu déterminer la structure tridimensionnelle à l’échelle atomique du complexe particule virale / Nb 23 », raconte Bruno Klaholz. « Nous avons découvert le mécanisme de reconnaissance moléculaire qui comprend une adaptation mutuelle entre la protéine de capside* et le nanobody. »
Cette visualisation 3D permet ainsi aux chercheurs d’avoir une vue de tout le site d’interaction entre le virus et le Nb23 et de savoir exactement où se lie le Nanobody sur la surface du virus. « Un site relativement étendu constitué de deux domaines de la protéine de capside. C’est surement du fait de cette interaction forte que s’opère la neutralisation du virus dans la plante », observe Christophe Ritzenthaler. A ce jour, il s’agit de la plus haute résolution en cryo-EM jamais obtenue pour un complexe avec un virus de plante.
Des tests hors laboratoire
L’étude met également en évidence qu’une forte quantité de virus permet de contourner la résistance des plantes dotées du Nb 23. En séquençant les virus parvenus à échapper au Nanobody, les chercheurs se sont rendu compte qu’ils présentaient une mutation de leur surface qui bloquerait l’accrochage du Nb 23 en interférant au niveau du site d’interaction de Nb 23 et de la capside du virus. Un procédé qui a son revers puisqu’une fois muté, le virus ne parvient plus à infecter d’autres plantes.
Reste à savoir exactement comment le virus est neutralisé par le Nb 23. « Ce qui pourrait être en lien avec la reconnaissance de cette région par un récepteur membranaire. Nous allons continuer à étudier les données », souligne Bruno Klaholz. Des tests hors laboratoire sont aussi en préparation dans le cadre du Labcom pour voir si les Nanobodies pourraient être exploités de manière commerciale.
Marion Riegert
* La capside est la structure qui entoure le génome.
Petite histoire de Nanobodies
Important information
Découverts en 1993 par un laboratoire belge, les Nanobodies sont les plus petits fragments d’anticorps actuellement connus. Dérivés des immunoglobulines présentes chez les camélidés (chameau, lama, alpaca), ils ont la particularité d’être constitués d’une seule chaîne contre deux pour les autres anticorps. Plus faciles à manipuler, les Nanobodies sont devenus un outil très répandu dans le domaine médical.